荧光染料分子被激发后,会从ground state(S0)变到first excited singlet state (S1),之后会包含以下几个过程:
- 重新回到S0,并在ns的时间尺度内发出fluorescence
- 经过inter-system crossing弛豫到first excited triplet state (T1),并在μs的时间尺度内发出phosphorescence
- 如果存在FRET,则会将能量传递给acceptor,令acceptor从S0到S1,然后acceptor染料同样也会经历相同的弛豫过程
染料分子达到triplet state或发生猝灭,都会降低光子产生速率,对成像、荧光单分子检测,特别是对快过程的研究都会造成影响。
猝灭原理
化学因素
当染料处于S1时,其化学活性较高,容易与溶液中的singlet oxygen或自由基发生反应,造成染料化学结构改变,从而发生荧光猝灭,永久失去发光能力。
光物理因素
在较低的激发光强下,染料只经历three-level体系(S0, S1, T1),而在较高激发光强下(> ~70 kW/cm2),染料经历five-level体系(S0, S1, T1, Sn, Tn)1。
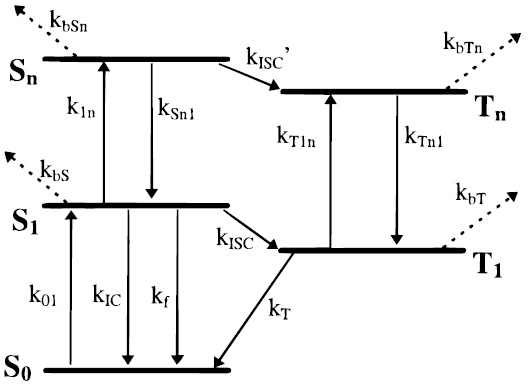
处于第一激发态的染料(S1或T1),还可吸收短波长的激光光子,进一步被激发到更高的能级(Sn或Tn),从而增大染料猝灭的概率2。
猝灭概率singlet > triplet
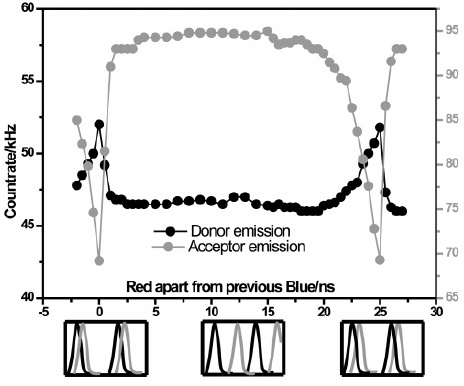
通过不同调控频率的ALEX激光,来研究染料singlet和triplet的猝灭概率2。
当ALEX激光的频率在ns尺度时,正好落在荧光寿命的时间尺度。红光先对acceptor染料分子激发,在ns尺度的延迟之后,蓝光进行激发,此时acceptor荧光分子处于S1,吸收蓝光光子,进一步激发到更高能级(Sn或Tn),发生猝灭,荧光信号降低。当延迟时间超过ns尺度后,acceptor的荧光信号得到恢复。
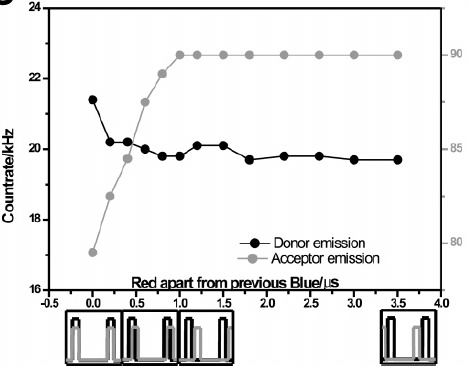
当ALEX的延迟时间在μs尺度时,此时染料分子应处于triplet state,而荧光信号改变不大。说明在smFRET中,猝灭主要是由acceptor染料的S1吸收短波长的光子带来的,可见染料猝灭的很大一部分原因,都是因为singlet state不能稳定地弛豫到ground state。
影响
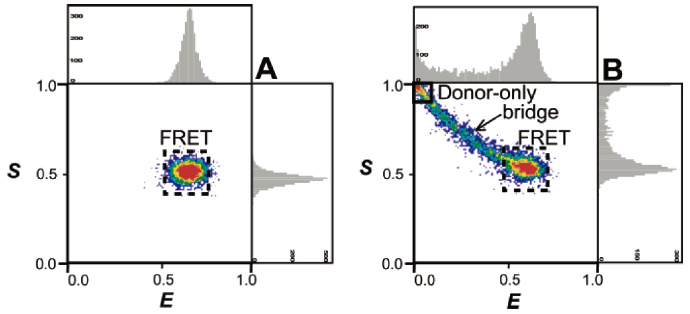
如果荧光分子的猝灭时间尺度和分子在confocal显微镜的聚焦体积内的扩散时间相当的话(~ 102 μs),那么single-molecule FRET的分布会有拖尾,因为分子在聚焦体积内,acceptor猝灭,此时donor仍发光,造成表观的FRET效率减小2,拖尾有时容易让人误以为是新组分的存在。
解决方法
除氧+Trolox
常用的除氧体系是葡萄糖+葡萄糖氧化酶+过氧化氢酶。然而氧气是非常高效的triplet quencher,因此将氧气除去后,需要再加入Trolox作为染料的triplet quencher。该配方一般用于表面固定的实验,减少荧光染料blinking和bleaching的概率。
Trolox cocktail
2010年的一篇Nature methods指出,buffer不除氧而是添加10 mM半胱胺(\(\ce{ NH2-CH2-CH2-SH }\))和1 mM Trolox,其中半胱胺作为singlet oxygen和自由基的quencher,Trolox作为染料triplet quencher,可以大大增加染料的光子产生速率3,单分子FRET实验可以达到50 μs的时间分辨率4。
References
- Eggeling, Christian, et al. "Photobleaching of fluorescent dyes under conditions used for single-molecule detection: Evidence of two-step photolysis." Analytical chemistry 70.13 (1998): 2651-2659.
- Kong, Xiangxu, et al. "Photobleaching pathways in single-molecule FRET experiments." Journal of the American Chemical Society 129.15 (2007): 4643-4654
- Campos, Luis A., et al. "A photoprotection strategy for microsecond-resolution single-molecule fluorescence spectroscopy." Nature methods 8.2 (2011): 143.
- Liu, Jianwei, et al. "Exploring one-state downhill protein folding in single molecules." Proceedings of the National Academy of Sciences 109.1 (2012): 179-184.